一、前沿药Luvelta获得FDA快速通道认证
Luvelta是由美国Sutro Biopharma公司研发的一款靶向叶酸受体α(FRα)的抗体偶联药物(ADC),设计用于治疗一系列卵巢癌患者,包括FRα表达水平较低且不符合现有治疗条件的患者。
除了针对铂类耐药卵巢癌患者的REFRaME-O1试验,围绕Luvelta还在开展针对CBF/GLIS急性髓系白血病(一种罕见的急性髓系白血病亚型)的试验(REFRaME-P1),以及针对子宫内膜癌、非小细胞肺癌和联合贝伐单抗(Avastin)治疗卵巢癌的其他在研试验。
美国食品药品监督管理局(FDA)已授予Luvelta治疗卵巢癌的快速通道认证,以及针对CBF/GLIS小儿急性髓系白血病的罕见病和孤儿药认证。
Sutro Biopharma公司计划于2027年向美国食品药品监督管理局(FDA)申请加速批准Luvelta上市。
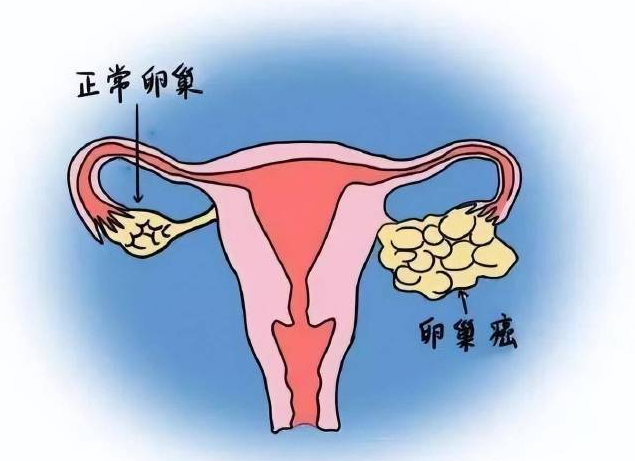
二、Luvelta将惠及更多卵巢癌患者:
铂类耐药卵巢癌指的是对传统铂类化疗药物(如顺铂或卡铂)失去反应的卵巢癌患者,这类患者的治疗选择通常较为有限。
根据2/3期REFRaME-O1试验的初步数据结果:前沿抗体偶联药物(ADC)Luveltamab Tazevibulin(又名Luvelta),在选定剂量下,针对铂类耐药卵巢癌,产生了积极的疗效。
在接受5.2 mg/kg起始剂量Luvelta治疗的可评估患者中,客观缓解率(ORR)为32%,即有32%的患者肿瘤显著缩小或完全消失。疾病控制率(DCR)达到了96%。
对此,美国莱文癌症研究所教授Wendel Naumann博士表示:
“Luvelta在REFRaME-O1试验第一部分中的安全性数据令人鼓舞。中性粒细胞减少率较低,管理措施成功。此外,没有报告严重的眼部损害、全血细胞减少或间质性肺病,进一步增强了我们为铂类耐药卵巢癌患者提供以整体健康为重点治疗的信心。”
美国佛罗里达癌症专家Bradley Monk博士则表示:
“REFRaME-O1试验第一部分的临床结果提供了令人信服的证据,表明Luvelta有潜力成为FRα低至中等表达患者的头个和蕞佳治疗选择。FRα是一个经过验证的靶点,而Luvelta有机会惠及更多有需求的患者。”