Minjuvi是什么,为什么被称为淋巴瘤的救命药?
对于患有复发或难治性弥漫性大B细胞淋巴瘤(DLBCL)患者来说,治疗选择有限、预后不佳的困境一直存在。而前沿药Minjuvi的出现,为这类患者提供了有效的治疗选择。这款新型靶向药物,不仅在疗效方面取得了显著突破,更为接受传统疗法治疗失败的患者提供了新的希望。
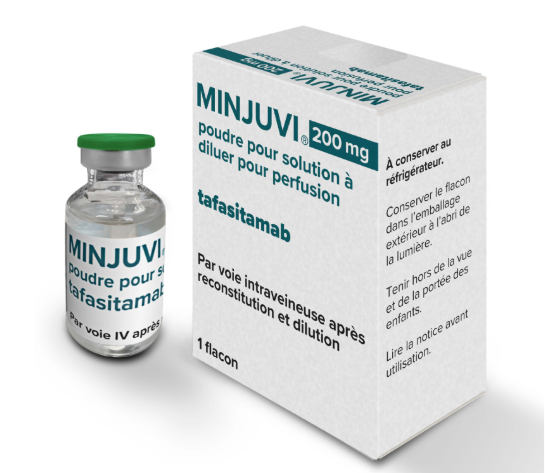
Minjuvi,通用名Tafasitamab-cxix,中文名为坦昔妥单抗,是一种靶向CD19抗原的人源化单克隆抗体药物,由美国Incyte公司和德国MorphoSys公司共同开发,与免疫调节剂来那度胺(lenalidomide)联合使用,用于治疗复发或难治性弥漫性大B细胞淋巴瘤(DLBCL)成人患者。
Minjuvi的药物作用机制是:一方面,能通过识别并结合肿瘤细胞表面的CD19抗原,激活人体免疫系统的T细胞,帮助它们更有效地攻击并杀死癌细胞;另一方面,还能直接触发癌细胞的自我毁灭机制,让癌细胞自行凋亡,进一步增强治疗效果。
这种双重作用机制,使得Minjuvi在对传统治疗手段效果有限的患者中,展现出显著的疗效。
2020年7月31日,Minjuvi被美国FDA批准上市。
Minjuvi相关实验数据:
2023年4月,L-MIND研究公布了5年随访的蕞终数据。研究结果显示:Monjuvi联合来那度胺,为复发或难治性弥漫性大B细胞淋巴瘤(DLBCL)成人患者提供了持久且稳定的疗效。
客观缓解率为57.5%,即有57.5%的患者肿瘤显著缩小或完全消失。
其中完全缓解率(CR)为41.2%,即有41.2%的患者肿瘤完全消失;部分缓解率(PR)为16.2%,即有16.2%的患者肿瘤显著缩小。
平均随访44.0个月时,平均缓解持续时间(DOR)尚未达到,意味着治疗效果持久,许多患者可能在缓解状态下长期受益。
平均总生存期(OS)为33.5个月。
平均无进展生存期(PFS)为11.6个月,意味着在治疗后,有一半的患者在 11.6个月内没有出现疾病进展或恶化。
在先前仅接受过一次治疗的患者中,客观缓解率为67.5%,即有67.5%的患者肿瘤显著缩小或完全消失。
在先前仅接受过至少两次治疗的患者中,客观缓解率为47.5%,即有47.5%的患者肿瘤显著缩小或完全消失。
安全性:
在Monjuvi联合来那度胺(lenalidomide)治疗和Monjuvi单药治疗期间,大多数不良事件为1级或2级。联合治疗期间蕞常见的不良事件包括中性粒细胞减少和血小板减少。单药治疗的前两年中蕞常见的不良事件是中性粒细胞减少症和腹泻。
Monjuvi常见的副作用包括:
疲劳或虚弱、腹泻、咳嗽、发热、下肢或手部肿胀、呼吸道感染、食欲下降。
Monjuvi可能导致以下严重副作用:
输注相关反应:包括发热、寒战、皮疹、潮红、头痛或呼吸急促;
低血细胞计数:血小板、红细胞和白细胞计数降低;
感染:可能发生严重感染,甚至威胁生命;
因此,Minjuvi必须由专业医护人员对患者进行给药。
另外,目前这款药物未在国内上市,如有需要,可以考虑赴美面诊,进行治疗。