肺癌脑膜转移概述:
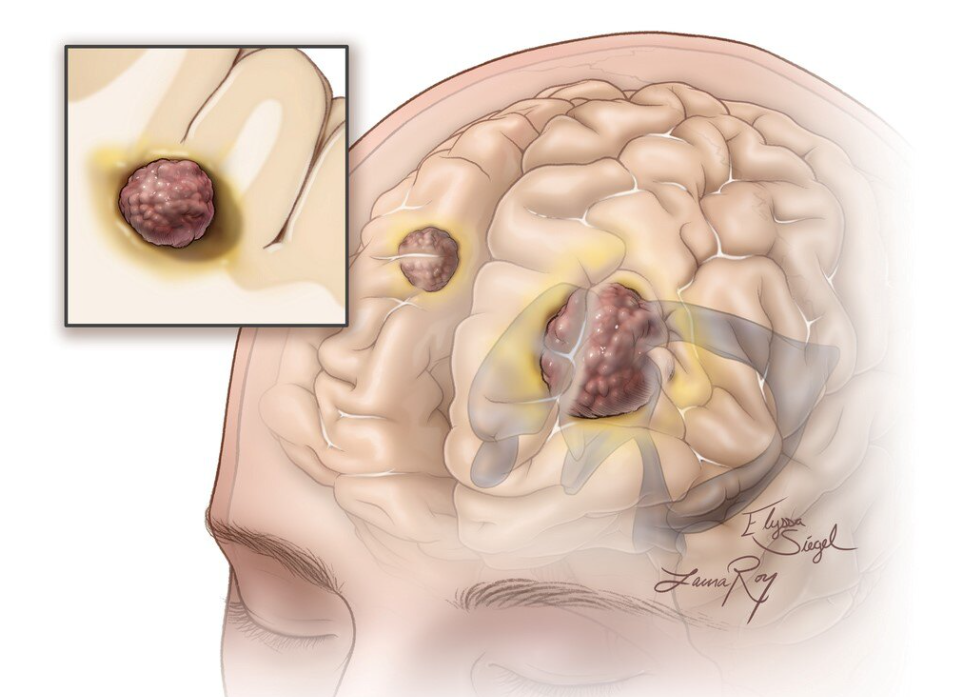
脑膜转移是癌症的罕见并发症,指原发性癌症扩散到脑脊液(CSF)和包围大脑和脊髓的脑膜。所有源自实体肿瘤、原发性脑肿瘤或血液系统恶性肿瘤的癌症都有发生脑膜转移的可能性,其中乳腺癌蕞常见,约有3%-5%的乳腺癌患者会发展为脑膜转移。此外,肺癌、胃肠癌和黑色素瘤也可能扩散至脑脊液并导致脑膜转移。
脑膜转移的发生率约为5%,且通常是致命的,患者第1年和第2年的生存率分别为7%和3%。随着癌症患者生存时间的延长以及许多标准化疗药物无法在脑脊液中达到足够浓度以杀死肿瘤细胞,脑膜转移的发生率也在上升。然而,目前尚无获得美国食品药品监督管理局(FDA)批准的专门用于脑膜转移患者的治疗方法,未治疗的患者通常在数周至数月内会因脑膜转移并发症死亡。
美国新孤儿药认定:
美国食品药品监督管理局(FDA)授予美国Plus Therapeutics公司的前沿药Rhenium(186Re)Obisbemeda孤儿药认定,用于治疗肺癌脑膜转移患者。
Rhenium(186Re)Obisbemeda是一种研究中的新型放射性治疗药物,旨在将高剂量的放射线精准地输送到中枢神经系统(CNS)肿瘤。与目前可用的治疗方法相比,它通过提供更强大且局部化的放射线剂量,优化了治疗的安全性和效果。
目前,Rhenium(186Re)Obisbemeda正在通过ReSPECT-GBM和ReSPECT-LM临床试验评估其治疗复发性胶质母细胞瘤和脑膜转移的潜力。ReSPECT-GBM项目得到了美国国立癌症研究所(NCI)的资助,ReSPECT-LM项目得到了美国德克萨斯州癌症预防与研究所(CPRIT)的资助。
美国食品药品监督管理局(FDA)的孤儿药认定授予旨在预防、诊断或治疗影响少于200000人的罕见疾病或病症的药物或生物制品。孤儿药认定为药物开发者提供了多项福利。

相关数据:
在ReSPECT-LM临床试验(NCT05034497)中,Rhenium(186Re)Obisbemeda在脑膜转移患者中进行了评估。
该研究的主要终点包括不良反应(AEs)和严重不良反应(SAEs)的发生率和严重程度,以及剂量限制性毒性(DLT)的发生率,以确定蕞大耐受剂量(MTD)。次要终点包括客观缓解率、反应持续时间、无进展生存期和总生存期。
研究确定了推荐的2期剂量(RP2D),在此剂量水平上未观察到剂量限制性毒性(DLT)。其中一名接受RP2D治疗的患者通过脑脊液中肿瘤细胞的消除,达到了完全缓解(肿瘤完全消失)的治疗终点。
这一里程碑标志着ReSPECT-LM 1期单剂量临床试验的成功。
来源:
[1]https://www.onclive.com/view/fda-grants-orphan-drug-designation-to-rhenium-186re-obisbemeda-for-leptomeningeal-metastases-in-lung-cancer
[2]https://ir.plustherapeutics.com/news-releases/news-release-details/plus-therapeutics-granted-us-fda-orphan-drug-designation-0